BAB I
PENDAHULUAN
1.1 Latar Belakang
Kehidupan manusia pada zaman sekarang tidak dapat dipisah dari bahan-bahan kimia. hampir seluruh bagian dari kehidupan manusia berhubungan sangat erat dengan bahan-bahan kimia. dalam kehidupan rumah tangga, kesehatan, perhiasan dan lain-lain hampir seluruhnya menggunakan bahan kimia. dalam suatu reaksi kimia, terdapat perbedaan laju reaksi antara reaksi yang satu dengan reaksi yang lain. misalnya, ketika kita membakar kertas reaksi berlangsung cepat. Sedangkan, reaksi pembakaran minyak bumi memakan waktu yang sangat lama.
Proses berlangsungnya suatu reaksi kimia dipengaruhi oleh beberapa faktor. Suatu reaksi akan berlangsung secara cepat apabila frekuensi tumbukan antar partikel dari zat-zat yang bereaksi sering terjadi titik sebaliknya, reaksi akan berlangsung secara lambat apabila hanya sedikit partikel zat zat yang mengalami tumbukan titik beberapa faktor yang mempengaruhi ketika reaksi adalah konsentrasi luas permukaan suhu dan katalis. menurut tumbukan, reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi. akan tetapi, tidaklah setiap tumbukan menghasilkan reaksi, melainkan hanya tumbukan antar partikel yang memiliki energi cukup serta arah tumbukan yang tepat. Laju reaksi sangat penting untuk dipelajari karena karena dengan mengetahui laju reaksi dan mengetahui hal-hal yang mempengaruhinya sehingga dapat menerapkannya dalam kehidupan, misalnya dalam kegiatan industri, dengan mengetahui laju reaksi dapat membuat produksi lebih terdeteksi sehingga dapat jumlah produk dalam waktu yang bisa diperhitungkan.
Oleh karena itu, percobaan laju reaksi ini dilakukan agar praktikum praktikan dapat lebih memahami tentang laju reaksi dan memahami faktor-faktor yang dapat mempengaruhi laju reaksi serta pengaruh konsentrasi dan pengaruh suhu pada laju reaksi.
1.2 Tujuan Praktikum
- Untuk mengetahui faktor-faktor yang mempengaruhi laju reaksi pada praktikum kali ini
- Untuk mengetahui pengaruh suhu terhadap laju reaksi
- Untuk mengetahui jenis orde reaksi yang terjadi pada percobaan kali ini
BAB II
TINJAUAN PUSTAKA
Laju reaksi merupakan peristiwa perubahan konsentrasi reaktan atau produk dalam satuan waktu. Laju reaksi juga dapat dinyatakan sebagai suatu laju terhadap berkurangnya konsentrasi suatu pereaksi. Konstanta laju reaksi merupakan laju reaksi bila konsentrasi dari masing-masing jenis adalah satu (Keenan, 1984).
Kecepatan laju reaksi yang berbanding lurus terhadap konsentrasi dengan satu atau dua pengikut berpangkat dua akan disebutkan sesuai jumlah pangkat. Reaksi disebut bertingkat tiga bila kecepatan reaksinya berbanding lurus dengan konsentrasi pangkat tiga. Biasanya laju reaksi tidak bergantung pada orde reaksi, suatu reaksi yang merupakan proses satu tahap didefinisikan dengan berdasarkan reaksinya yaitu reaksi dasar (Petrucci, 1982).
Molaritas menyatakan banyaknya mol zat terlarut dalam tiap liter larutan. Normalitas menyatakan jumlah ekivalen zat terlarut dalam tiap liter larutan. Molalitas menyatakan jumlah mol zat terlarut dalam tiap 1000 g pelarut murni. Sedangkan fraksi mol menyatakan perbandingan mol salah satu komponen dengan jumlah mol semua komponen (Syukri, 1999).
Berdasarkan teori tumbukan yang menyatakan bahwa sebelum terjadinya reaksi molekul pereaksi haruslah saling bertumbukan sehingga sebagian molekul pada tumbukan ini akan membentuk suatu molekul. Molekul yang akan mampu bersifat mengaktivasi diri secara langsung. Molekul tersebut kemudian berubah menjadi hasil reaksi agar reaksi dapat
membentuk kompleks yang akan aktif. Walaupun demikian, molekul-molekul ini hanya akan mempunyai energi minimum yang disebut energi aktivasi (Sukardjo, 2002).
Hubungan antara laju reaksi dengan molaritas adalah.
Dengan:
v = Laju reaksi
k = Konstanta laju reaksi
[A] = Konsentrasi zat A
[B] = Konsentrasi zat B
m = Orde terhadap zat A
n = Orde terhadap zat B
Persamaan laju reaksi untuk suatu zat a dapat ditulis sebagai berikut.
RA = Laju reaksi
n = Jumlah mol zat A yang terbentuk
t = Waktu
Ra memiliki harga positif jika zat tersebut terbentuk dan akan memiliki harga negatif jika zat tersebut digunakan untuk bereaksi (Atkins, 1996).
Adapun faktor-faktor yang mempengaruhi laju reaksi atau kecepatan reaksi.
- Konsentrasi. Jika kecepatan suatu zat semakin besar maka laju reaksinya semakin besar pula dan sebaliknya jika konsentrasi semakin kecil maka laju reaksinya semakin kecil pula. Untuk beberapa reaksi laju reaksi dapat dinyatakan dengan persamaan matematis yang dikenal dengan hukum laju reaksi atau persamaan laju reaksi. Pangkat-pangkat dalam persamaan laju reaksi dinamakan orde reaksi. Menentukan orde reaksi dalam suatu reaksi kimia pada prinsipnya menentukan pengaruh seberapa besar perubahan konsentrasi laju reaksi terhadap konsentrasi pereaksi (Charles, 2004).
- Luas permukaan. Reaksi yang berlangsung dalam sistem homogen sangat berbeda dengan reaksi yang berlangsung dalam sistem heterogen. Pada reaksi homogen campuran zatnya bercampur seluruhnya. Hal ini dapat mempercepat berlangsungnya reaksi kimia karena molekul-molekul ini dapat bersentuhan satu sama lain. Dalam sistem reaksi hanya berlangsung pada bidang-bidang yang bersentuhan dari kedua fase yang bereaksi. Reaksi kimia berlangsung pada kedua molekul-molekul, atom-atom, atau ion-ion dari zat-zat yang bereaksi terlebih dahulu bertumbukan. Semakin luas permukaan suatu reaksi maka semakin cepat reaksi itu berlangsung (Charles, 1882).
- Suhu/temperatur. Pada suhu yang tinggi, energi molekul-molekul bertambah. Laju reaksi meningkat dengan naiknya suhu. Biasanya kenaikan suhu sebesar 10°C akan menyebabkan kenaikan laju reaksi sebesar dua atau tiga kalinya. Kenaikan laju reaksi ini disebabkan dengan kenaikan suhu atau menyebabkan semakin cepatnya molekul-molekul bergerak sehingga memperbesar kemungkinan terjadi tabrakan yang efektif. Energi tumbukan suatu reaksi dapat berlangsung disebut energi aktivasi (Chang, 2001).
- Katalis. Berbagai reaksi berlangsung lambat dapat dipercepat dengan menambahkan zat lain yang disebut dengan katalis. Konsep yang menerapkan pengaruh terhadap laju reaksi diantaranya katalis menurunkan energi energi pengaktifan suatu reaksi dengan jalan membentuk tahap-tahap reaksi yang baru. Ada dua jenis katalis yaitu katalis homogen adalah katalis yang satu fase dengan zat yang jenis katalis ini umumnya ikut bereaksi tetapi pada akhirnya reaksi akan kembali ke bentuk semula. Katalis heterogen adalah katalis yang tidak satu fase dengan zat-zat yang bereaksi jenis katalis ini umumnya logam-logam dan reaksi yang tercepat umumnya pada gas (Supardi, 2008).
Orde suatu reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju berbentuk diferensial. Pada umumnya orde reaksi merupakan bilangan bulat dan kecil namun dalam beberapa kasus dapat berupa bilangan pecahan atau nol. Orde reaksi terhadap suatu zat tertentu tidak sama dengan koefisien dalam persamaan stoikiometri. Reaksi harga n memberikan orde reaksi jika n = 0 maka laju reaksinya disebut orde nol terhadap X. Hal ini berarti bahwa perubahan konsentrasi tidak berpengaruh pada laju reaksi (Chang, 2001).
Teori tumbukan pada kinetika kimia menyatakan bahwa molekul gas sering bertumbukan satu dengan yang lainnya. Jadi sangat masuk akal jika kita menganggapnya benar bahwa reaksi kimia berlangsung sebagai akibat dari tumbukan antar molekul-molekul yang bereaksi. Dari segi teori tumbukan dari kinetika kimia maka kita perkirakan laju reaksi akan berbanding lurus dengan banyaknya tumbukan molekul per detik atau berbanding lurus dengan frekuensi tumbukan molekul.
Sifat fisika dan kimia dari HCl adalah memiliki massa molar 38,34 gram per mol, cairan tidak berwarna, tidak berbau, memiliki massa jenis 1,18 gram per cm3, memiliki titik lebur -27,32°C, memiliki titik didih 48°C dan terlarut sepenuhnya dalam air. Sifat fisika dan kimia dari Na2S2O3 adalah memiliki massa molar 158,11 gram per mol (anhidrat) dan 248, 18 gram per mol (pentahidrat), berpenampilan seperti kristal putih, tidak berbau, memiliki massa jenis 1,667 gram per cm3, memiliki titik lebur 48,3°C, memiliki titik didih 100°C, memiliki kelarutan dalam air 70,1 gram per Ml pada suhu 20°C dan dalam suhu ruangan keduanya berwujud cair (Jolly, 1984).
BAB III
METODOLOGI PERCOBAAN
3.1 Alat dan Bahan
3.1.1 Alat – alat
- Gelas kimia 50 ml
- Gelas ukur 25 ml
- Termometer
- Hot plate
- Stopwatch
- Botol Semprot
- Statif dan klem
- Penjepit tabung reaksi
- Corong kaca
- Pipet volume 10 mL
- Bulb
3.1.2 Bahan
- Larutan Na2S2O3 0,1 M
- Larutan Na2S2O3 0,2 M
- Larutan HCl 0,1 M
- Larutan HCl 0,2 M
- Kertas
- Aquades
- Tisu
3.2 Prosedur Percobaan
3.2.1 Pengaruh konsentrasi pada laju reaksi
- Disiapkan kertas yang telah diberikan tanda silang dan diletakkan di bawah gelas kimia 100 ml.
- Diukur larutan sebanyak 10 ml Na2S2O3 0,1 M di gelas ukur lalu dituangkan ke gelas kimia.
- Diukur larutan sebanyak 10 ml HCl 0,2 M di gelas ukur lalu dicampurkan dengan 10 ml Na2S2O3 0,1 M.
- Dihitung waktu yang diperlukan sejak penuangan HCl 0,2 M tadi dengan menggunakan stopwatch.
- Diamati sampai tanda silang tidak terlihat lagi dan catat waktu.
- Diulangi langkah yang sama untuk larutan 10 ml Na2S2O3 0,2 M.
3.2.2 Pengaruh suhu pada laju reaksi
- Disiapkan kertas yang telah diberi tanda silang.
- Diukur larutan sebanyak 10 ml Na2S2O3 0,1 M di gelas ukur lalu dituang ke gelas kimia.
- Diletakkan gelas kimia di atas hot plate lalu diukur suhu sampai 25°C menggunakan termometer.
- Diukur larutan sebanyak 10 ml HCl 0,2 M di gelas ukur.
- Diletakkan di atas kertas yang telah diberi tanda silang tadi setelah sampai pada suhu 25°C.
- Dihitung larutan 10 ml HCl 0,2 M kedalam gelas kimia yang dipanaskan tadi.
- Dihitung waktu yang diperlukan sejak penuangan HCl 0,2 M tadi dengan menggunakan stopwatch.
- Diamati sampai tanda silang tidak terlihat lagi dan catat waktu.
- Diulangi langkah yang sama untuk larutan 10 ml Na2S2O3 0,2 M dengan larutan 10 ml HCl 0,1 M dengan suhu 40°C dan 10 ml Na2S2O3 0,2 M dengan larutan 10 ml HCl 0,2 M dengan suhu 60°C.
- Dibandingkan data ini dengan jika tanpa pemanas (perlakuan 1).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan
4.1.1 Pengaruh Konsentrasi Terhadap Laju Reaksi
| No | Konsentrasi Na2S2O3 | [HCl] | Waktu (detik) | v = |
| 1 | 0,1 molar | 0,2 molar | 103 detik | 0,0106 |
| 2 | 0,2 molar | 0,1 molar | 50 detik | 0,02 |
| 3 | 0,2 molar | 0,2 molar | 45 detik | 0,023 |
4.1.2 Pengaruh Suhu Terhadap Laju Reaksi
| No | Konsentrasi Na2S2O3 | Konsentrasi HCl | Suhu | Waktu (detik) | |
| 1. | 0,1 molar | 0,2 molar | 25oC | 103 detik | 0,0106 |
| 2. | 0,2 molar | 0,1 molar | 40oC | 23 detik | 0,043 |
| 3. | 0,2 molar | 0,2 molar | 60oC | 9 detik | 0,111 |
4.2 Reaksi
4.3 Perhitungan
4.3.1 Perhitungan Konsentrasi
4.3.2 Perhitungan Suhu
4.4 Grafik
Grafik 4.4.1 Pengaruh Konserntrasi Terhadap Laju Reaksi
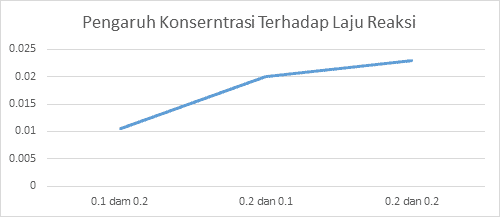
Grafik 4.4.2 Pengaruh Suhu Terhadap Laju Reaksi
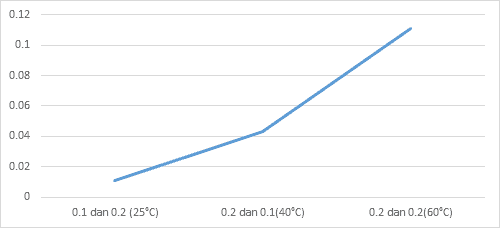
4.5 Pembahasan
Pada praktikum kali ini, telah dilakukan dua percobaan yaitu pengaruh konsentrasi terhadap laju reaksi dan percobaan pengaruh suhu terhadap laju reaksi. Pada percobaan yang pertama, yaitu percobaan pengaruh konsentrasi terhadap laju reaksi yang pertama kali harus dilakukan adalah dengan menyiapkan gelas kimia yang di bawahnya diletakkan kertas yang telah diberi tanda silang titik pada percobaan yang pertama, yaitu dengan menggunakan 10 Ml larutan Na2S2O3 0,1 M dan larutan HCl 0,210 Ml. Kemudian larutan tersebut dicampur ke dalam gelas kimia dan menggunakan Stopwatch di hitung waktu reaksinya yang dapat dilihat dari larutan yang akan menjadi keruh dan tanda silang di bawah gelas kimia sudah tak terlihat lagi. Pada percobaan yang pertama ini, didapat waktu 103 detik. Yang kedua dengan menggunakan 10 Ml larutan Na2S2O3 0,2 M dan 10 Ml HCl 0,1 M dan prosedur yang dilakukannya sama dengan percobaan pertama dan setelah diamati dan dihitung didapat hasil yaitu 50 detik titik pada percobaan yang ketiga yaitu dengan menggunakan 10 Ml larutan Na2S2O3 0,2 M dan 10 ml larutan HCl 0,2 m setelah dicampur kan dan dihitung waktu Sampai warna larutan menjadi keruh didapatkan hasil yaitu selama 45 detik pada percobaan yang kedua yaitu percobaan pengaruh terhadap laju reaksi yang pertama yang harus disiapkan yaitu kertas yang telah diberi tanda silang yang nantinya akan diletakkan gelas kimia yang akan diletakkan di atasnya titik percobaan yang pertama yaitu dengan menggunakan 10 ml Na2S2O3 dan 10 Ml HCl, didapatkan hasil yang sama seperti pada percobaan pertama pada pengaruh konsentrasi yaitu 103 detik. Pada percobaan yang kedua, dituangkan 10 Ml larutan Na2S2O3 0,2 M ke dalam gelas kimia yang lalu diletakkan di atas hotplate dan Ditunggu sampai suhunya mencapai 40ºC yaitu dengan mengamatinya menggunakan termometer. saat suhunya telah mencapai 1040ºC lalu dicampurkan dengan menuangkan 10 Ml HCl 0,1 m ke dalam gelas kimia yang sama. kemudian dihitung waktunya dengan menggunakan stopwatch sampai larutan menjadi keruh dan tanda silang tidak terlihat. Na2S2O3.
Hal ini dapat terjadi dikarenakan suhu yang tinggi dapat membuat partikel-partikel dalam zat menjadi lebih aktif untuk bertabrakan dan dapat mempercepat reaksi. dan dapat dilihat juga dari hasilnya yaitu pada Suhu 25ºC laju reaksinya hanya selama 94 detik pada suhu 40ºC selama 23 detik dan pada suhu yang paling tinggi pada percobaan kali ini yaitu 60ºC laju reaksinya dapat berlangsung hanya selama kurang lebih 9 detik. jadi bisa disimpulkan bahwa konsentrasi dan suhu berpengaruh pada laju reaksi titik berdasarkan dengan grafik yang telah dibuat, juga dapat disimpulkan bahwa kecepatannya juga terus bertambah naik. pada percobaan yang pertama, yaitu pengaruh konsentrasi terhadap laju reaksi didapat hasil grafik yang terus naik yaitu dari kecepatan reaksi dari 0,010, 0,02 dan sampai 0,023 dan hasil tersebut didapat karena konsentrasi yang dipakai semakin besar. pada percobaan yang kedua yaitu Pengaruh suhu terhadap laju reaksi didapat hasil grafik yang terus naik yaitu dari kecepatan reaksi 0,010 6, 0,043 sampai 0,111 dan Hasil tersebut didapat karena semakin lama suhu yang ingin dicapai, maka akan semakin besar yaitu dari 25ºC, 40ºC sampai dengan 60 ºC. Prinsip percobaan pada praktikum kali ini adalah mereaksikan suatu reaktan dengan konsentrasi salah satu spesies dibuat konstan dan spesi yang lainnya dibuat beragam untuk mengetahui pengaruh nya terhadap laju reaksi, dalam hal ini, larutan yang akan digunakan pada praktikum kali ini adalah larutan Na2S2O3 dan larutan HCl. Serta mereaksikan suatu larutan tersebut dengan konsentrasi yang berbeda dan dengan suhu yang berbeda-beda titik Hal ini dilakukan dengan tujuan untuk mengetahui bagaimana pengaruh suhu terhadap suhu dan pengaruh konsentrasi terhadap laju reaksi.
Hal ini dapat terjadi dikarenakan suhu yang tinggi dapat membuat partikel-partikel dalam zat menjadi lebih aktif untuk bertabrakan dan dapat mempercepat reaksi. dan dapat dilihat juga dari hasilnya yaitu pada Suhu 25ºC laju reaksinya hanya selama 94 detik pada suhu 40ºC selama 23 detik dan pada suhu yang paling tinggi pada percobaan kali ini yaitu 60ºC laju reaksinya dapat berlangsung hanya selama kurang lebih 9 detik. jadi bisa disimpulkan bahwa konsentrasi dan suhu berpengaruh pada laju reaksi.
Pada percobaan kali ini, adapun fungsi alat-alat pada praktikum ini yaitu ada gelas kimia 50 Ml yang berfungsi untuk mengukur volume larutan ataupun bahan yang tidak memerlukan ketelitian yang tinggi titik gelas ukur 2,5 Ml digunakan sebagai alat ukur volume cairan yang tidak memerlukan ketelitian yang tinggi, termometer berfungsi untuk mengukur suhu atau temperatur maupun perubahan suhu dari suatu zat tertentu. Selain itu ada juga hot plate yang berfungsi untuk memanaskan suatu campuran zat tertentu. sampel yang dipanaskan ditempatkan ke dalam labu Erlenmeyer atau gelas kimia. yang terdapat pada alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. stopwatch berfungsi untuk menghitung waktu sampai tanda silang yang terdapat pada kertas saring tersebut hilang. fungsi pipet filler atau rubber bulb digunakan untuk memindahkan sejumlah volume larutan, yang biasanya disebut dengan aliquot, filler merupakan alat untuk menyedot larutan yang dipasang pada pangkal pipet ukur. pipet ukur 10 Ml fungsi untuk mengambil larutan dengan jumlah ketelitian yang tinggi dan dalam skala ukuran yang kecil. fungsi dari klem dan statif yaitu klem berfungsi untuk memegang atau menjepit buret corong dan peralatan lainnya sedangkan statif berfungsi untuk menegakkan buret corong pisah dan peralatan lainnya.
Adapun beberapa bahan yang terdapat dalam praktikum kali ini dan memiliki fungsi Yaitu sebagai salah satu zat yang digunakan untuk mengukur laju reaksi yaitu larutan Na2S2O3 dan larutan HCl dengan konsentrasi yang berbeda-beda titik adapun fungsi bahan lainnya yaitu kertas, kertas berfungsi untuk menuliskan tanda silang titik pensil berfungsi untuk menulis simbol tanda silang pada kertas yang terdapat di bawah gelas kimia. Adapun aquades yang berfungsi untuk mencuci alat-alat yang dipakai pada saat praktikum. Fungsi perlakuan yang dilakukan pada praktikum kali ini adalah yang pertama Fungsi diletakkan di kertas yang telah diberi tanda silang yaitu agar kita mengetahui waktu yang diperlukan agar suatu reaksi dapat berlangsung sampai tanda silang itu agar kita mengetahui waktu yang diperlukan agar suatu reaksi dapat berlangsung yaitu sampai tanda silang tidak terlihat lagi karena larutan menjadi keruh titik fungsi larutan dipanaskan yaitu agar larutan dapat mencapai suhu yang ingin dicapai, fungsi diukur larutan menggunakan termometer adalah agar kita dapat melihat kenaikan suhunya pada saat dipanaskan, pengukuran larutan sebanyak 10 Ml dengan menggunakan gelas ukur adalah agar larutan yang dipakai perbandingannya sama sehingga pada saat dicampur dan bereaksi larutan dapat menjadi putih keruh, dihitung waktu dengan menggunakan stopwatch adalah agar mendapatkan hasil perhitungan dengan akurat dan tepat dan fungsi digunakannya hot plate adalah berfungsi untuk memanaskan larutan sampai pada suhu yang ingin dicapai.
Faktor kesalahan yang didapat pada praktikum kali ini adalah pada saat mengukur menggunakan gelas ukur, ada beberapa larutan yang tidak tepat pada 10 Ml dan pada saat menggunakan termometer, ujung termometer nya dipegang yang seharusnya tidak dipegang karena dapat memasuk dapat merusak dan mempengaruhi kinerja termometer tersebut pada saat memanaskan suhu yang didapat kurang pas dan tidak tepat yaitu kelebihan atau kekurangan dari suhu yang ingin dicapai, juga kurang bersihnya saat membersihkan gelas kimia yang digunakan sehingga hasil kurang tepat dan menjadi tidak akurat.
BAB V
PENUTUP
5.1 Kesimpulan
- Konstanta pengaruh konsentrasi terhadap laju reaksi yaitu 389,15 pada percobaan pengaruh suhu dalam laju reaksi dihasilkan konstanta konstanta dengan besar 9,24 titik konstanta ini didapat dengan cara mencari nilai k atau konstanta pada pengaruh konsentrasi dan suhu setelah mengetahui orde reaksi dari masing-masing senyawa.
- Dalam percobaan ini, suhu juga mempunyai dan mempengaruhi laju reaksi. Didapat percobaan pertama, 10 Ml Na2S2O3 0,1 m dengan suhu 25°C dengan 10 Ml HCl 0,2 M. lama waktu yang diperlukan sampai tanda silang tidak terlihat adalah 103 detik. Pada percobaan ke-2, 10 ml Na2S2O3 0,2 M yang telah dipanaskan diatas hotplate hingga suhu 40°C dicampur dengan 10 Ml HCl 0,1 M. lama waktu yang diperlukan sampai tanda silang tidak terlihat adalah 23 detik. Pada percobaan yang ketiga, 10 Ml Na2S2O3 0,2 m yang telah dipanaskan diatas hot plate suhu 60°C dicampur titik dengan 10 Ml HCl 0,2 M lama waktu yang diperlukan sampai tanda silang tidak terlihat adalah 9 detik.
- Terdapat beberapa faktor yang mempengaruhi laju reaksi seperti katalis yang merupakan zat yang dapat meningkatkan laju reaksi tanpa mempengaruhi hasil reaksi titik berikutnya adalah suhu yaitu semakin tinggi suhu maka reaksi semakin lambat juga. luas permukaan, untuk campuran heterogen reaksi hanya terjadi pada bidang batas campuran yang disebut bidang sentuh titik konsentrasi, semakin tinggi konsentrasi maka semakin laju reaksinya semakin rendah konsentrasinya maka semakin lambat reaksinya.
5.2 Saran
Sebaiknya digunakan tidak hanya menggunakan gunakan larutan Na2S2O3 dan HCl tetapi menggunakan bahan lain misalnya paku, lempeng Zn, lempeng Cu, H2SO4, dan lain-lain.
DAFTAR PUSTAKA
Atkins, P.W. 1996. Kamus Lengkap Kimia. Rineka Cipta: Jakarta.
Chang, Raymond. 2006. Kimia Dasar : Konsep-Konsep Inti Jilid 2. Erlangga: Jakarta.
Charles, W. 1992. Kimia untuk Universitas. Gramedia: Jakarta.
Keenan, C.W., D.C. Klemfelter, dan J.H. Wood. 1984. Kimia untuk Universitas. Erlangga: Jakarta.
Oxtoby, David W., dkk. 2001. Prinsip-Prinsip Kimia Modern Jilid 1. Erlangga: Jakarta.
Sukardjo. 2002. Kimia Fisik. Rineka Cipta: Jakarta. Syukri, S. 1999. Kimia Dasar 2. ITB: Bandung.
No comments:
Post a Comment
terimakasih telah mengunjungi blog saya.