Semakin aku banyak membaca, semakin aku banyak berpikir; semakin aku banyak belajar, semakin aku sadar bahwa aku tak mengetahui apa pun. - "Voltaire"
Monday, 21 March 2022
Saturday, 19 March 2022
Nanopartikel boron karbida untuk keramik dengan kekerasan tinggi : Cacat kristal setelah perawatan di pabrik bola penggiling ( Ball Mill )
Nanopartikel boron karbida untuk
keramik dengan kekerasan tinggi : Cacat
kristal setelah perawatan di pabrik bola penggiling ( Ball Mill )
ABSTRAK
Fitur deformasi
dari kisi boron karbida yang ditreament di pabrik bola penggilingan (ball
mill) dipelajari dalam penelitian ini.
Hal ini menunjukkan bahwa perlakuan tersebut menyebabkan penurunan ukuran butir
B4C dan retak di sepanjang bidang {20¯21}h, sedangkan
perlakuan yang sama pada saat diberikan silikon menyebabkan munculnya kembaran
di sepanjang bidang {10¯11. Kesalahan susunan terdistorsi disepanjang bidang
(10¯14) diamati. Simulasi ab initio menunjukkan, bahwa di antara bidang kristalografi
indeks rendah {20¯21} dan {10¯11}memiliki nilai energi permukaan spesifik
terkecil yang menyebabkan terjadinya cacat dan retakan.
LATAR BELAKANG
Boron karbida
memiliki serangkaian sifat kimia, fisik dan mekanik yang menonjol. Boron
karbida (B4C) adalah material yang keras, kuat, dan ringan dengan berbagai
aplikasi. Ini digunakan, misalnya, dalam peralatan militer, sebagai bahan
penyerap neutron, untuk bagian abrasif dan tahan aus, dll. B4C dan
keramik lain yang memiliki kekerasan tinggi digunakan dalam kondisi pembebanan
kejut yang intens, oleh karena itu perlu untuk menggambarkan daya tahannya di
bawah kondisi tersebut. kondisi. Proses deformasi boron karbida telah
dipelajari dalam beberapa penelitian. Transformasi struktural boron karbida
yang diinduksi telah dilaporkan lekukan instatik, lekukan dinamis, dan
eksperimen goresan. Dalam, pengamatan TEM telah menunjukkan zona amorf besar
yang terbentuk di dalam area kontak lekukan. B4C amorf dan nanokristalin
diamati pada lekukan dinamis menghasilkan tingkat perubahan struktural yang
lebih besar dibandingkan dengan lekukan statis. Kekerasan yang lebih rendah,
ketangguhan patah, dan tingkat kerusakan yang lebih besar di bawah pembebanan
dinamis dibandingkan dengan pembebanan statis, dapat dikaitkan dengan
pembentukan sejumlah besar fase amorf lokal yang lebih lemah daripada fase
kristal asli di boron karbida.
TUJUAN
Untuk
mempelajari struktur boron karbida (B4C) yang digunakan secara luas
untuk produksi keramik dengan kekerasan tinggi
METODA PENELITIAN
Serbuk (B4C dan Si)
-
Dianalisis dengan kandungan
Si yang berbeda-beda : 99,5% Si dan 0,5% B4C, 99% Si dan 1% B4C,
95% Si dan 5% B4C, dan B4C murni
Komponen Prekursor
-
Ditreatment di Micro Mill
dengan drum keramik dan bola penggilingan Si3N4
-
Waktu penggilingannya
adalah 2 jam, dan ukuran partikel mendekati 10-15 nm.
Sampel
-
Dianalisis dengan TEM
JEM-2010 dengan melampikran EDS dan EELS
-
Dilarutkan sampel secara
kimia dalam campuran asam nitrat dan etsa
-
Dilakukan perhitungan ab
initio dengan menggunakan teori fungsi densitas (DFT) dalam pendekatan
gradien umum dengan fungsi korelasi pertukaran Perdew-Burke-Ernzerhof (PBE)
Optimalisasi Struktur
Atom
-
Dilakukan hingga gaya antar
atom maksimum menjadi kurang dari 0,05 eV/Å
-
Ketebalan pelat diatur
tidak kurang dari 10
HASIL PENELITIAN
Pada hasil studi
TEM menunjukkan bahwa semua sampel setelah perlakuan mengandung retakan. Ketika
boron karbida murni menjadi sasaran ball milling, tidak ada kembaran, politipe
atau cacat kisi kristal lainnya (selain retakan) yang diamati. Lalu, pada saat
yang sama, dalam sampel di mana konsentrasi Si mendominasi (sekitar 95% dan
lebih), diamati ada terjadinya struktur kembar dan susun. Seperti yang terlihat
pada gambar a menunjukkan sebuah fragmen partikel B4C dari
sampel dengan silikon yang membentuk 99,5% dari massanya. Dimna, partikel
tersebut kembar. Seperti yang terlihat pada transformasi Fourier yang sesuai (Gambar
b), yaitu pada bidang kembaran {10¯11}h. Karena jumlah partikel
boron karbida dalam bahan yang digiling sangat kecil, partikel tersebut
sepenuhnya dikelilingi oleh partikel silikon dan terdeformasi melalui lapisan
silikon di sekitarnya. Dalam hal ini, Si berfungsi sebagai media transfer
tekanan. Rupanya, kondisi seperti itu mengakibatkan munculnya kembaran dan
kesalahan susun di B4C. Struktur kembar di B4C
diverifikasi sebagai (0001)-jenis cacat planar.
Boron carbide
nanolumps pada permukaan nanotube karbon multiwall memiliki bidang kembar
pada(10¯11)h, ditemukan kepadatan tinggi dari bidang kembar {10¯11}
dan kesalahan susunan diamati pada sampel B13C2 yang
ditekan panas. Ditunjukkan bahwa bidang kembar {10¯11} ditemukan pada spesimen
B4C yang dipres panas di bawah 2000◦C. Kembar yang terbentuk dalam
boron karbida dalam jumlah besar biasanya merupakan kembar deformasi. Kembar
B4C asimetris dengan bidang (100) twinning ditemukan di Siklik {100}kembar
tipe-r diamati menggunakan hubungan orientasi (OR) antara kisi heksagonal dan
belah ketupat dari boron karbida. Oleh karena itu, kembar di {10¯11}diamati
dalam penelitian ini, muncul sebagai hasil dari treatment B4C di
pabrik bola penggiling ball mill, mirip dengan deformasi dan pertumbuhan kembar
yang diamati dalam penelitian lain. Bidang kembaran mengandung ikosahedral yang
dihubungkan oleh ikatan interikosahedral (gambar a) yang menghubungkan
atom-atom di situs kutub dari ikosahedral tetangga dan berasal dari orbital
hibridisasi sp.
Gambar a
menunjukkan beberapa garis (pita) yang hampir sejajar pada boron car-bide yang
menyerupai retakan. Struktur kristal pada kedua sisi garis ini sama, tetapi
sedikit disorientasi, seperti dapat dilihat pada transformasi Fourier pada Gambar
b. Bintik-bintik refleksi menjadi dua kali lipat dan sedikit melebar. Lebar
garis (kemungkinan besar retakan) tidak melebihi 1 nm dan sama dengan lebar
beberapa jarak antar bidang untuk kisi-kisi ini. Mereka terletak di bidang
{20¯21}h. Secara total, kami memeriksa 16 partikel yang mengandung pita
deformasi tersebut. Dalam 12 partikel pita-pita ini terletak di bidang{20¯21}h
Senyawa B4C mengandung
boron icosahedra yang diselingi dengan rantai yang terdiri dari tiga atom karbon
yang sejajar sepanjang sumbu c. Dalam senyawa B13C2 salah
satu atom ini dapat digantikan oleh boron seperti yang ditunjukkan pada gambar
b mewakili struktur B4C di bidang {20¯21}h
ditampilkan secara skematis (dalam sel heksagonal).
Gambar a,b menunjukkan terjadinya
cacat. Cacat ini terjadi di sepanjang bidang {10¯14}h dan sejajar
satu sama lain. Cacat ini terjadi dalam jumlah yang besar dan terletak jauh lebih
dekat di area kecil yang ditunjukkan pada gambar. Transformasi Fourier dari
gambar ini pada Gambar. c membuktikan adanya cacat di seluruh area gambar.
Struktur ini mirip dengan kesalahan susun, tetapi terdistorsi Ternyata, alasan
distorsi adalah deformasi icosahedra. Kehadiran ikosahedra ini membuat
kesalahan susun dalam boron karbida sangat berbeda dari kesalahan susun
"tradisional" pada bahan tanpa ikosahedra.
Didapatkan bahwa permukaan indeks
rendah pada bidang(10¯10), (01¯10) dan (0001) dan permukaan indeks tinggi
(10¯11), (20¯23), (20¯21) dari kristal B4C (gambar a ).
Ditemukan bahwa energi permukaan akhir lebih rendah daripada energi permukaan
sebelumnya. Dimana (10¯11), (20¯23), (20¯21) bidang menunjukkan energi yang
lebih rendah dan oleh karena itu bidang ini paling lemah untuk terjadinya
retakan atau kembaran (Gambar b). Hasil ini sangat sesuai dengan
pengamatan eksperimental.
KESIMPULAN
- Cacat
pada struktural boron karbida dipelajari dengan TEM resolusi tinggi.
- Diamati
tiga jenis cacat: retak sempit (lebar sekitar 1 nm) sepanjang {20¯21}h,
kembaran sepanjang {10¯11}h, dan cacat sepanjang {10¯14}h
yang tampaknya merupakan patahan susun yang sangat terdistorsi.
- Simulasi
numerik menunjukkan bahwa munculnya fitur cacat ini di sepanjang bidang
kristalografi dengan indeks seperti itu didukung oleh energi
pembentukannya yang relatif rendah.
- Twinning
( kembaran) hanya terjadi pada sampel yang dilakukan ball milling ditambah
dengan jumlah Si yang besar (lebih dari 95%).
Thursday, 17 March 2022
Pengantar Analisis Bahan Makanan Menggunakan Metode Instrumentasi (Spektrofotometri dan Kromatografi)
Pengertian dan Spektrofotometri dan Kromatografi
Spektrofotometri -> Merupakan metode pengukuran kuantitatif dalam kimia
analisis
terhadap sifat
refleksi atau transmisi cahaya suatu materi sebagai
fungsi dari panjang gelombang.
Kromatografi
-> Suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan
antara fase gerak dan fase diam untuk memisahkan komponen (berupa molekul) yang berada pada larutan.
Macam- Macam Analisis Spektrofotometri
1. Spektofotometri
UV-Vis
Alat untuk mengukur transmitan atau absorban suatu sampel
sebagai fungsi panjang
gelombang pada daerah UV
(200-350 nm) dan visible (350-800 nm)
2.
Spektrofotometri IR
Suatu metode yang mengamati interaksi molekul dengan radiasi
elektromagnetik yang berada pada daerah panjang gelombang 0,75-1000 µm atau pada bilangan gelombang
13.000-10 ![]()
3. SpektofoSpektrometri Serapan Atom (SSA)
Suatu metoda yang digunakan untuk menen- tukan
konsentrasi unsur logam tertentu
dalam suatu cuplikan.
4. Spektrofotometer
Resonansi Magnetik Inti (NMR)
Salah satu metode analisis untuk menentukan struktur molekul
dari komponen alami dan
sintetik, kemurnian dari komponen, dan arah
reaksi kimia.
Syarat Pengukuran Spektrofotometri
Sampel bisa
berupa larutan, gas, atau uap. Pada umumnya sampel harus diubah menjadi suatu
larutan yang jernih.
Untuk sampel yang
berupa larutan perlu diperhatikan
beberapa
persyaratan
pelarut yang dipakai antara lain:
- Harus melarutkan sampel dengan
sempurna.
- Pelarut yang dipakai tidak mengandung
ikatan rangkap
terkonjugasi pada struktur molekulnya
dan tidak berwarna
(tidak boleh mengabsorpsi sinar yang
dipakai oleh sampel)
3. Tidak terjadi interaksi dengan molekul
senyawa yang dianalisis
4. Kemurniannya harus tinggi.
Macam-Macam Analisis Kromatografi
1. Kromatografi
kertas
Jenis kromatografi yang menggunakan fase kertas
stasioner.
2. Kromatografi lapis tipis
Dilakukan pada plat terbuat dari gelas atau aluminium atau
plastik yang diatasnya diratakan selapis tipis fase diam.
3. Kromatografi kolom
Jenis kromatografi yang dapat dilakukan dengan kolom gelas.
Pada umumnya, jenis kromatografi kolom ini digunakan untuk melakukan pemisahan
pigmen pada tanaman.
4. Kromatografi gas
Metode yang dinamis untuk pemisahan dan deteksi
senyawa-senyawa organik yang mudah menguap dan senyawa-senyawa gas anorganik
dalam suatu campuran.
Syarat Pengukuran Kromatografi
Syarat pengukuran kromatografi :
1). Ada fasa diam
dan fasa gerak. Fasa diam tidak boleh bereaksi
dengan fasa
gerak.
2). Komponen
sampel (contoh) harus larut dalam fasa gerak dan
berinteraksi
dengan fasa tetap (diam).
3). Fasa gerak
harus bisa mengalir melewati fasa diam, sedangkan
fasa diam harus
terikat kuat di posisinya.
Laporan Praktikum Kimia Dasar Laju Reaksi
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kehidupan manusia pada zaman sekarang tidak dapat dipisah dari bahan-bahan kimia. hampir seluruh bagian dari kehidupan manusia berhubungan sangat erat dengan bahan-bahan kimia. dalam kehidupan rumah tangga, kesehatan, perhiasan dan lain-lain hampir seluruhnya menggunakan bahan kimia. dalam suatu reaksi kimia, terdapat perbedaan laju reaksi antara reaksi yang satu dengan reaksi yang lain. misalnya, ketika kita membakar kertas reaksi berlangsung cepat. Sedangkan, reaksi pembakaran minyak bumi memakan waktu yang sangat lama.
Proses berlangsungnya suatu reaksi kimia dipengaruhi oleh beberapa faktor. Suatu reaksi akan berlangsung secara cepat apabila frekuensi tumbukan antar partikel dari zat-zat yang bereaksi sering terjadi titik sebaliknya, reaksi akan berlangsung secara lambat apabila hanya sedikit partikel zat zat yang mengalami tumbukan titik beberapa faktor yang mempengaruhi ketika reaksi adalah konsentrasi luas permukaan suhu dan katalis. menurut tumbukan, reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi. akan tetapi, tidaklah setiap tumbukan menghasilkan reaksi, melainkan hanya tumbukan antar partikel yang memiliki energi cukup serta arah tumbukan yang tepat. Laju reaksi sangat penting untuk dipelajari karena karena dengan mengetahui laju reaksi dan mengetahui hal-hal yang mempengaruhinya sehingga dapat menerapkannya dalam kehidupan, misalnya dalam kegiatan industri, dengan mengetahui laju reaksi dapat membuat produksi lebih terdeteksi sehingga dapat jumlah produk dalam waktu yang bisa diperhitungkan.
Oleh karena itu, percobaan laju reaksi ini dilakukan agar praktikum praktikan dapat lebih memahami tentang laju reaksi dan memahami faktor-faktor yang dapat mempengaruhi laju reaksi serta pengaruh konsentrasi dan pengaruh suhu pada laju reaksi.
1.2 Tujuan Praktikum
- Untuk mengetahui faktor-faktor yang mempengaruhi laju reaksi pada praktikum kali ini
- Untuk mengetahui pengaruh suhu terhadap laju reaksi
- Untuk mengetahui jenis orde reaksi yang terjadi pada percobaan kali ini
BAB II
TINJAUAN PUSTAKA
Laju reaksi merupakan peristiwa perubahan konsentrasi reaktan atau produk dalam satuan waktu. Laju reaksi juga dapat dinyatakan sebagai suatu laju terhadap berkurangnya konsentrasi suatu pereaksi. Konstanta laju reaksi merupakan laju reaksi bila konsentrasi dari masing-masing jenis adalah satu (Keenan, 1984).
Kecepatan laju reaksi yang berbanding lurus terhadap konsentrasi dengan satu atau dua pengikut berpangkat dua akan disebutkan sesuai jumlah pangkat. Reaksi disebut bertingkat tiga bila kecepatan reaksinya berbanding lurus dengan konsentrasi pangkat tiga. Biasanya laju reaksi tidak bergantung pada orde reaksi, suatu reaksi yang merupakan proses satu tahap didefinisikan dengan berdasarkan reaksinya yaitu reaksi dasar (Petrucci, 1982).
Molaritas menyatakan banyaknya mol zat terlarut dalam tiap liter larutan. Normalitas menyatakan jumlah ekivalen zat terlarut dalam tiap liter larutan. Molalitas menyatakan jumlah mol zat terlarut dalam tiap 1000 g pelarut murni. Sedangkan fraksi mol menyatakan perbandingan mol salah satu komponen dengan jumlah mol semua komponen (Syukri, 1999).
Berdasarkan teori tumbukan yang menyatakan bahwa sebelum terjadinya reaksi molekul pereaksi haruslah saling bertumbukan sehingga sebagian molekul pada tumbukan ini akan membentuk suatu molekul. Molekul yang akan mampu bersifat mengaktivasi diri secara langsung. Molekul tersebut kemudian berubah menjadi hasil reaksi agar reaksi dapat
membentuk kompleks yang akan aktif. Walaupun demikian, molekul-molekul ini hanya akan mempunyai energi minimum yang disebut energi aktivasi (Sukardjo, 2002).
Hubungan antara laju reaksi dengan molaritas adalah.
Dengan:
v = Laju reaksi
k = Konstanta laju reaksi
[A] = Konsentrasi zat A
[B] = Konsentrasi zat B
m = Orde terhadap zat A
n = Orde terhadap zat B
Persamaan laju reaksi untuk suatu zat a dapat ditulis sebagai berikut.
RA = Laju reaksi
n = Jumlah mol zat A yang terbentuk
t = Waktu
Ra memiliki harga positif jika zat tersebut terbentuk dan akan memiliki harga negatif jika zat tersebut digunakan untuk bereaksi (Atkins, 1996).
Adapun faktor-faktor yang mempengaruhi laju reaksi atau kecepatan reaksi.
- Konsentrasi. Jika kecepatan suatu zat semakin besar maka laju reaksinya semakin besar pula dan sebaliknya jika konsentrasi semakin kecil maka laju reaksinya semakin kecil pula. Untuk beberapa reaksi laju reaksi dapat dinyatakan dengan persamaan matematis yang dikenal dengan hukum laju reaksi atau persamaan laju reaksi. Pangkat-pangkat dalam persamaan laju reaksi dinamakan orde reaksi. Menentukan orde reaksi dalam suatu reaksi kimia pada prinsipnya menentukan pengaruh seberapa besar perubahan konsentrasi laju reaksi terhadap konsentrasi pereaksi (Charles, 2004).
- Luas permukaan. Reaksi yang berlangsung dalam sistem homogen sangat berbeda dengan reaksi yang berlangsung dalam sistem heterogen. Pada reaksi homogen campuran zatnya bercampur seluruhnya. Hal ini dapat mempercepat berlangsungnya reaksi kimia karena molekul-molekul ini dapat bersentuhan satu sama lain. Dalam sistem reaksi hanya berlangsung pada bidang-bidang yang bersentuhan dari kedua fase yang bereaksi. Reaksi kimia berlangsung pada kedua molekul-molekul, atom-atom, atau ion-ion dari zat-zat yang bereaksi terlebih dahulu bertumbukan. Semakin luas permukaan suatu reaksi maka semakin cepat reaksi itu berlangsung (Charles, 1882).
- Suhu/temperatur. Pada suhu yang tinggi, energi molekul-molekul bertambah. Laju reaksi meningkat dengan naiknya suhu. Biasanya kenaikan suhu sebesar 10°C akan menyebabkan kenaikan laju reaksi sebesar dua atau tiga kalinya. Kenaikan laju reaksi ini disebabkan dengan kenaikan suhu atau menyebabkan semakin cepatnya molekul-molekul bergerak sehingga memperbesar kemungkinan terjadi tabrakan yang efektif. Energi tumbukan suatu reaksi dapat berlangsung disebut energi aktivasi (Chang, 2001).
- Katalis. Berbagai reaksi berlangsung lambat dapat dipercepat dengan menambahkan zat lain yang disebut dengan katalis. Konsep yang menerapkan pengaruh terhadap laju reaksi diantaranya katalis menurunkan energi energi pengaktifan suatu reaksi dengan jalan membentuk tahap-tahap reaksi yang baru. Ada dua jenis katalis yaitu katalis homogen adalah katalis yang satu fase dengan zat yang jenis katalis ini umumnya ikut bereaksi tetapi pada akhirnya reaksi akan kembali ke bentuk semula. Katalis heterogen adalah katalis yang tidak satu fase dengan zat-zat yang bereaksi jenis katalis ini umumnya logam-logam dan reaksi yang tercepat umumnya pada gas (Supardi, 2008).
Orde suatu reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju berbentuk diferensial. Pada umumnya orde reaksi merupakan bilangan bulat dan kecil namun dalam beberapa kasus dapat berupa bilangan pecahan atau nol. Orde reaksi terhadap suatu zat tertentu tidak sama dengan koefisien dalam persamaan stoikiometri. Reaksi harga n memberikan orde reaksi jika n = 0 maka laju reaksinya disebut orde nol terhadap X. Hal ini berarti bahwa perubahan konsentrasi tidak berpengaruh pada laju reaksi (Chang, 2001).
Teori tumbukan pada kinetika kimia menyatakan bahwa molekul gas sering bertumbukan satu dengan yang lainnya. Jadi sangat masuk akal jika kita menganggapnya benar bahwa reaksi kimia berlangsung sebagai akibat dari tumbukan antar molekul-molekul yang bereaksi. Dari segi teori tumbukan dari kinetika kimia maka kita perkirakan laju reaksi akan berbanding lurus dengan banyaknya tumbukan molekul per detik atau berbanding lurus dengan frekuensi tumbukan molekul.
Sifat fisika dan kimia dari HCl adalah memiliki massa molar 38,34 gram per mol, cairan tidak berwarna, tidak berbau, memiliki massa jenis 1,18 gram per cm3, memiliki titik lebur -27,32°C, memiliki titik didih 48°C dan terlarut sepenuhnya dalam air. Sifat fisika dan kimia dari Na2S2O3 adalah memiliki massa molar 158,11 gram per mol (anhidrat) dan 248, 18 gram per mol (pentahidrat), berpenampilan seperti kristal putih, tidak berbau, memiliki massa jenis 1,667 gram per cm3, memiliki titik lebur 48,3°C, memiliki titik didih 100°C, memiliki kelarutan dalam air 70,1 gram per Ml pada suhu 20°C dan dalam suhu ruangan keduanya berwujud cair (Jolly, 1984).
BAB III
METODOLOGI PERCOBAAN
3.1 Alat dan Bahan
3.1.1 Alat – alat
- Gelas kimia 50 ml
- Gelas ukur 25 ml
- Termometer
- Hot plate
- Stopwatch
- Botol Semprot
- Statif dan klem
- Penjepit tabung reaksi
- Corong kaca
- Pipet volume 10 mL
- Bulb
3.1.2 Bahan
- Larutan Na2S2O3 0,1 M
- Larutan Na2S2O3 0,2 M
- Larutan HCl 0,1 M
- Larutan HCl 0,2 M
- Kertas
- Aquades
- Tisu
3.2 Prosedur Percobaan
3.2.1 Pengaruh konsentrasi pada laju reaksi
- Disiapkan kertas yang telah diberikan tanda silang dan diletakkan di bawah gelas kimia 100 ml.
- Diukur larutan sebanyak 10 ml Na2S2O3 0,1 M di gelas ukur lalu dituangkan ke gelas kimia.
- Diukur larutan sebanyak 10 ml HCl 0,2 M di gelas ukur lalu dicampurkan dengan 10 ml Na2S2O3 0,1 M.
- Dihitung waktu yang diperlukan sejak penuangan HCl 0,2 M tadi dengan menggunakan stopwatch.
- Diamati sampai tanda silang tidak terlihat lagi dan catat waktu.
- Diulangi langkah yang sama untuk larutan 10 ml Na2S2O3 0,2 M.
3.2.2 Pengaruh suhu pada laju reaksi
- Disiapkan kertas yang telah diberi tanda silang.
- Diukur larutan sebanyak 10 ml Na2S2O3 0,1 M di gelas ukur lalu dituang ke gelas kimia.
- Diletakkan gelas kimia di atas hot plate lalu diukur suhu sampai 25°C menggunakan termometer.
- Diukur larutan sebanyak 10 ml HCl 0,2 M di gelas ukur.
- Diletakkan di atas kertas yang telah diberi tanda silang tadi setelah sampai pada suhu 25°C.
- Dihitung larutan 10 ml HCl 0,2 M kedalam gelas kimia yang dipanaskan tadi.
- Dihitung waktu yang diperlukan sejak penuangan HCl 0,2 M tadi dengan menggunakan stopwatch.
- Diamati sampai tanda silang tidak terlihat lagi dan catat waktu.
- Diulangi langkah yang sama untuk larutan 10 ml Na2S2O3 0,2 M dengan larutan 10 ml HCl 0,1 M dengan suhu 40°C dan 10 ml Na2S2O3 0,2 M dengan larutan 10 ml HCl 0,2 M dengan suhu 60°C.
- Dibandingkan data ini dengan jika tanpa pemanas (perlakuan 1).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan
4.1.1 Pengaruh Konsentrasi Terhadap Laju Reaksi
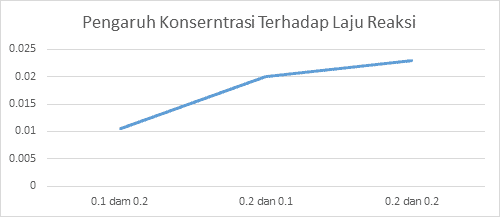
| No | Konsentrasi Na2S2O3 | [HCl] | Waktu (detik) | v = |
| 1 | 0,1 molar | 0,2 molar | 103 detik | 0,0106 |
| 2 | 0,2 molar | 0,1 molar | 50 detik | 0,02 |
| 3 | 0,2 molar | 0,2 molar | 45 detik | 0,023 |
4.1.2 Pengaruh Suhu Terhadap Laju Reaksi
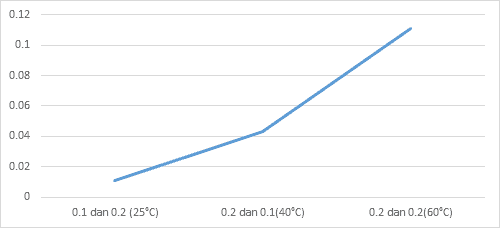
| No | Konsentrasi Na2S2O3 | Konsentrasi HCl | Suhu | Waktu (detik) | |
| 1. | 0,1 molar | 0,2 molar | 25oC | 103 detik | 0,0106 |
| 2. | 0,2 molar | 0,1 molar | 40oC | 23 detik | 0,043 |
| 3. | 0,2 molar | 0,2 molar | 60oC | 9 detik | 0,111 |
4.2 Reaksi
4.3 Perhitungan
4.3.1 Perhitungan Konsentrasi
4.3.2 Perhitungan Suhu
4.4 Grafik
Grafik 4.4.1 Pengaruh Konserntrasi Terhadap Laju Reaksi
Grafik 4.4.2 Pengaruh Suhu Terhadap Laju Reaksi
4.5 Pembahasan
Pada praktikum kali ini, telah dilakukan dua percobaan yaitu pengaruh konsentrasi terhadap laju reaksi dan percobaan pengaruh suhu terhadap laju reaksi. Pada percobaan yang pertama, yaitu percobaan pengaruh konsentrasi terhadap laju reaksi yang pertama kali harus dilakukan adalah dengan menyiapkan gelas kimia yang di bawahnya diletakkan kertas yang telah diberi tanda silang titik pada percobaan yang pertama, yaitu dengan menggunakan 10 Ml larutan Na2S2O3 0,1 M dan larutan HCl 0,210 Ml. Kemudian larutan tersebut dicampur ke dalam gelas kimia dan menggunakan Stopwatch di hitung waktu reaksinya yang dapat dilihat dari larutan yang akan menjadi keruh dan tanda silang di bawah gelas kimia sudah tak terlihat lagi. Pada percobaan yang pertama ini, didapat waktu 103 detik. Yang kedua dengan menggunakan 10 Ml larutan Na2S2O3 0,2 M dan 10 Ml HCl 0,1 M dan prosedur yang dilakukannya sama dengan percobaan pertama dan setelah diamati dan dihitung didapat hasil yaitu 50 detik titik pada percobaan yang ketiga yaitu dengan menggunakan 10 Ml larutan Na2S2O3 0,2 M dan 10 ml larutan HCl 0,2 m setelah dicampur kan dan dihitung waktu Sampai warna larutan menjadi keruh didapatkan hasil yaitu selama 45 detik pada percobaan yang kedua yaitu percobaan pengaruh terhadap laju reaksi yang pertama yang harus disiapkan yaitu kertas yang telah diberi tanda silang yang nantinya akan diletakkan gelas kimia yang akan diletakkan di atasnya titik percobaan yang pertama yaitu dengan menggunakan 10 ml Na2S2O3 dan 10 Ml HCl, didapatkan hasil yang sama seperti pada percobaan pertama pada pengaruh konsentrasi yaitu 103 detik. Pada percobaan yang kedua, dituangkan 10 Ml larutan Na2S2O3 0,2 M ke dalam gelas kimia yang lalu diletakkan di atas hotplate dan Ditunggu sampai suhunya mencapai 40ºC yaitu dengan mengamatinya menggunakan termometer. saat suhunya telah mencapai 1040ºC lalu dicampurkan dengan menuangkan 10 Ml HCl 0,1 m ke dalam gelas kimia yang sama. kemudian dihitung waktunya dengan menggunakan stopwatch sampai larutan menjadi keruh dan tanda silang tidak terlihat. Na2S2O3.
Hal ini dapat terjadi dikarenakan suhu yang tinggi dapat membuat partikel-partikel dalam zat menjadi lebih aktif untuk bertabrakan dan dapat mempercepat reaksi. dan dapat dilihat juga dari hasilnya yaitu pada Suhu 25ºC laju reaksinya hanya selama 94 detik pada suhu 40ºC selama 23 detik dan pada suhu yang paling tinggi pada percobaan kali ini yaitu 60ºC laju reaksinya dapat berlangsung hanya selama kurang lebih 9 detik. jadi bisa disimpulkan bahwa konsentrasi dan suhu berpengaruh pada laju reaksi titik berdasarkan dengan grafik yang telah dibuat, juga dapat disimpulkan bahwa kecepatannya juga terus bertambah naik. pada percobaan yang pertama, yaitu pengaruh konsentrasi terhadap laju reaksi didapat hasil grafik yang terus naik yaitu dari kecepatan reaksi dari 0,010, 0,02 dan sampai 0,023 dan hasil tersebut didapat karena konsentrasi yang dipakai semakin besar. pada percobaan yang kedua yaitu Pengaruh suhu terhadap laju reaksi didapat hasil grafik yang terus naik yaitu dari kecepatan reaksi 0,010 6, 0,043 sampai 0,111 dan Hasil tersebut didapat karena semakin lama suhu yang ingin dicapai, maka akan semakin besar yaitu dari 25ºC, 40ºC sampai dengan 60 ºC. Prinsip percobaan pada praktikum kali ini adalah mereaksikan suatu reaktan dengan konsentrasi salah satu spesies dibuat konstan dan spesi yang lainnya dibuat beragam untuk mengetahui pengaruh nya terhadap laju reaksi, dalam hal ini, larutan yang akan digunakan pada praktikum kali ini adalah larutan Na2S2O3 dan larutan HCl. Serta mereaksikan suatu larutan tersebut dengan konsentrasi yang berbeda dan dengan suhu yang berbeda-beda titik Hal ini dilakukan dengan tujuan untuk mengetahui bagaimana pengaruh suhu terhadap suhu dan pengaruh konsentrasi terhadap laju reaksi.
Hal ini dapat terjadi dikarenakan suhu yang tinggi dapat membuat partikel-partikel dalam zat menjadi lebih aktif untuk bertabrakan dan dapat mempercepat reaksi. dan dapat dilihat juga dari hasilnya yaitu pada Suhu 25ºC laju reaksinya hanya selama 94 detik pada suhu 40ºC selama 23 detik dan pada suhu yang paling tinggi pada percobaan kali ini yaitu 60ºC laju reaksinya dapat berlangsung hanya selama kurang lebih 9 detik. jadi bisa disimpulkan bahwa konsentrasi dan suhu berpengaruh pada laju reaksi.
Pada percobaan kali ini, adapun fungsi alat-alat pada praktikum ini yaitu ada gelas kimia 50 Ml yang berfungsi untuk mengukur volume larutan ataupun bahan yang tidak memerlukan ketelitian yang tinggi titik gelas ukur 2,5 Ml digunakan sebagai alat ukur volume cairan yang tidak memerlukan ketelitian yang tinggi, termometer berfungsi untuk mengukur suhu atau temperatur maupun perubahan suhu dari suatu zat tertentu. Selain itu ada juga hot plate yang berfungsi untuk memanaskan suatu campuran zat tertentu. sampel yang dipanaskan ditempatkan ke dalam labu Erlenmeyer atau gelas kimia. yang terdapat pada alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. stopwatch berfungsi untuk menghitung waktu sampai tanda silang yang terdapat pada kertas saring tersebut hilang. fungsi pipet filler atau rubber bulb digunakan untuk memindahkan sejumlah volume larutan, yang biasanya disebut dengan aliquot, filler merupakan alat untuk menyedot larutan yang dipasang pada pangkal pipet ukur. pipet ukur 10 Ml fungsi untuk mengambil larutan dengan jumlah ketelitian yang tinggi dan dalam skala ukuran yang kecil. fungsi dari klem dan statif yaitu klem berfungsi untuk memegang atau menjepit buret corong dan peralatan lainnya sedangkan statif berfungsi untuk menegakkan buret corong pisah dan peralatan lainnya.
Adapun beberapa bahan yang terdapat dalam praktikum kali ini dan memiliki fungsi Yaitu sebagai salah satu zat yang digunakan untuk mengukur laju reaksi yaitu larutan Na2S2O3 dan larutan HCl dengan konsentrasi yang berbeda-beda titik adapun fungsi bahan lainnya yaitu kertas, kertas berfungsi untuk menuliskan tanda silang titik pensil berfungsi untuk menulis simbol tanda silang pada kertas yang terdapat di bawah gelas kimia. Adapun aquades yang berfungsi untuk mencuci alat-alat yang dipakai pada saat praktikum. Fungsi perlakuan yang dilakukan pada praktikum kali ini adalah yang pertama Fungsi diletakkan di kertas yang telah diberi tanda silang yaitu agar kita mengetahui waktu yang diperlukan agar suatu reaksi dapat berlangsung sampai tanda silang itu agar kita mengetahui waktu yang diperlukan agar suatu reaksi dapat berlangsung yaitu sampai tanda silang tidak terlihat lagi karena larutan menjadi keruh titik fungsi larutan dipanaskan yaitu agar larutan dapat mencapai suhu yang ingin dicapai, fungsi diukur larutan menggunakan termometer adalah agar kita dapat melihat kenaikan suhunya pada saat dipanaskan, pengukuran larutan sebanyak 10 Ml dengan menggunakan gelas ukur adalah agar larutan yang dipakai perbandingannya sama sehingga pada saat dicampur dan bereaksi larutan dapat menjadi putih keruh, dihitung waktu dengan menggunakan stopwatch adalah agar mendapatkan hasil perhitungan dengan akurat dan tepat dan fungsi digunakannya hot plate adalah berfungsi untuk memanaskan larutan sampai pada suhu yang ingin dicapai.
Faktor kesalahan yang didapat pada praktikum kali ini adalah pada saat mengukur menggunakan gelas ukur, ada beberapa larutan yang tidak tepat pada 10 Ml dan pada saat menggunakan termometer, ujung termometer nya dipegang yang seharusnya tidak dipegang karena dapat memasuk dapat merusak dan mempengaruhi kinerja termometer tersebut pada saat memanaskan suhu yang didapat kurang pas dan tidak tepat yaitu kelebihan atau kekurangan dari suhu yang ingin dicapai, juga kurang bersihnya saat membersihkan gelas kimia yang digunakan sehingga hasil kurang tepat dan menjadi tidak akurat.
BAB V
PENUTUP
5.1 Kesimpulan
- Konstanta pengaruh konsentrasi terhadap laju reaksi yaitu 389,15 pada percobaan pengaruh suhu dalam laju reaksi dihasilkan konstanta konstanta dengan besar 9,24 titik konstanta ini didapat dengan cara mencari nilai k atau konstanta pada pengaruh konsentrasi dan suhu setelah mengetahui orde reaksi dari masing-masing senyawa.
- Dalam percobaan ini, suhu juga mempunyai dan mempengaruhi laju reaksi. Didapat percobaan pertama, 10 Ml Na2S2O3 0,1 m dengan suhu 25°C dengan 10 Ml HCl 0,2 M. lama waktu yang diperlukan sampai tanda silang tidak terlihat adalah 103 detik. Pada percobaan ke-2, 10 ml Na2S2O3 0,2 M yang telah dipanaskan diatas hotplate hingga suhu 40°C dicampur dengan 10 Ml HCl 0,1 M. lama waktu yang diperlukan sampai tanda silang tidak terlihat adalah 23 detik. Pada percobaan yang ketiga, 10 Ml Na2S2O3 0,2 m yang telah dipanaskan diatas hot plate suhu 60°C dicampur titik dengan 10 Ml HCl 0,2 M lama waktu yang diperlukan sampai tanda silang tidak terlihat adalah 9 detik.
- Terdapat beberapa faktor yang mempengaruhi laju reaksi seperti katalis yang merupakan zat yang dapat meningkatkan laju reaksi tanpa mempengaruhi hasil reaksi titik berikutnya adalah suhu yaitu semakin tinggi suhu maka reaksi semakin lambat juga. luas permukaan, untuk campuran heterogen reaksi hanya terjadi pada bidang batas campuran yang disebut bidang sentuh titik konsentrasi, semakin tinggi konsentrasi maka semakin laju reaksinya semakin rendah konsentrasinya maka semakin lambat reaksinya.
5.2 Saran
Sebaiknya digunakan tidak hanya menggunakan gunakan larutan Na2S2O3 dan HCl tetapi menggunakan bahan lain misalnya paku, lempeng Zn, lempeng Cu, H2SO4, dan lain-lain.
DAFTAR PUSTAKA
Atkins, P.W. 1996. Kamus Lengkap Kimia. Rineka Cipta: Jakarta.
Chang, Raymond. 2006. Kimia Dasar : Konsep-Konsep Inti Jilid 2. Erlangga: Jakarta.
Charles, W. 1992. Kimia untuk Universitas. Gramedia: Jakarta.
Keenan, C.W., D.C. Klemfelter, dan J.H. Wood. 1984. Kimia untuk Universitas. Erlangga: Jakarta.
Oxtoby, David W., dkk. 2001. Prinsip-Prinsip Kimia Modern Jilid 1. Erlangga: Jakarta.
Sukardjo. 2002. Kimia Fisik. Rineka Cipta: Jakarta. Syukri, S. 1999. Kimia Dasar 2. ITB: Bandung.








